Medcleの臨床成績(承認時評価資料)についてご紹介します。
検証的試験結果論文:Y. Watanabe, et al. Effect of smartphone based cognitive behavioral therapy app on insomnia: a randomized, double-blind study. Sleep, Volume 46, Issue 3, March 2023, zsac270 論文を見る
目的
不眠障害患者を対象として、CBT-Iを治療原理とした治療を行う「サスメド 不眠障害用アプリ Medcle」(以下、Medcle)の治療開始後8 週時における有効性を、Shamソフトウェア(以下、Sham)を比較対照に、AISのベースラインからの変化量を主要評価項目として検証する。
対象
外来の不眠障害患者 175例(解析時)
[主な選択基準]
- ICSD-3に基づいた不眠障害に該当し治療を要する
- 睡眠衛生指導での治療効果が不十分(同意取得時に対する治験登録時のAISの差が5点未満)
- 20歳以上(同意取得時) など
[主な除外基準]
- AISが9点未満(同意取得時または治験登録時)
- 同意取得日から治験登録日までの睡眠の状況が睡眠表で把握できない、又は、把握できたとしてもそれ以上の改善を要さない
- M.I.N.Iにて薬剤治療が必要と判断される精神疾患合併例または薬剤治療中の精神疾患合併例
- 不眠障害以外の睡眠覚醒障害(睡眠関連呼吸障害や睡眠関連運動障害など)を合併 など
有効性評価項目
主要評価項目
- 治療開始後8週時のAISのベースラインからの変化量
副次評価項目
- 治療開始後8週時のAISの項目ごとのベースラインからの変化量
- 治療開始後8週時または中止時におけるAISが6点未満の患者の割合
- 治療開始後8週時のCGI-Iのベースラインからの変化量
- 治験終了時または中止時に薬剤治療が必要と判断された患者の割合
- 治療終了後の睡眠表(紙)およびアクチグラフで取得する入眠潜時、睡眠効率および中途覚醒回数のベースラインからの変化量
その他の解析
- 治療開始時から治験終了時までのAISの推移
安全性評価項目
- 有害事象および不具合
解析計画
有効性の解析対象はmITTとした。主要評価項目および副次評価項目の「治療開始後8週時のAISの項目ごとのベースラインからの変化量」、「治療開始後8週時のCGI-Iのベースラインからの変化量」、「治療終了後の睡眠表(紙)およびアクチグラフで取得する入眠潜時、睡眠効率および中途覚醒回数のベースラインからの変化量」の両群間の比較にはWelchのt検定(両側有意水準0.05)を用い、副次評価項目の「治療開始後8週時または中止時におけるAISが6点未満の患者の割合」の両群間の比較には母比率の差の検定(両側有意水準0.05)を用いた。
主要評価項目を患者背景(年齢、性別、BMI、既往歴・合併症、前治療薬、併用薬、併用療法、開始時のAIS)別に評価したサブグループ解析も実施し、両群間の比較にはWelchのt検定(両側有意水準0.05)を用いた。副次評価項目の「治験終了時または中止時の薬剤治療の要否」はそれぞれ治験終了時または中止時の薬剤治療の要否を集計し評価した。その他の解析である「治療開始時から治験終了時までのAISの推移」については、各時点の要約統計量を算出した。
患者背景(mITT)
| Sham群 (n=88) | Medcle群 (n=87) | |
|---|---|---|
| 年齢 平均値±標準偏差 | 45.9 ±13.2歳 | 42.4 ±13.5歳 |
| 20歳以上40歳未満 | 35例 | 41例 |
| 40歳以上65歳未満 | 45例 | 40例 |
| 65歳以上 | 8例 | 6例 |
| 性別 (男性 / 女性) | 41例 / 47例 | 32例 / 55例 |
| BMI 平均値±標準偏差 (kg/m²) | 22.4 ±3.7 | 22.7 ±4.8 |
| 既往歴・合併症 | ||
| あり | 26例 | 26例 |
| なし | 62例 | 61例 |
| 前治療薬 | ||
| あり | 0例 | 0例 |
| なし | 88例 | 87例 |
| 併用薬 | ||
| あり | 31例 | 26例 |
| なし | 57例 | 61例 |
| 併用療法 | ||
| あり | 0例 | 0例 |
| なし | 88例 | 87例 |
| 開始時のAIS 平均値±標準偏差 (点) | 13.6 ±2.9 | 13.4 ±2.8 |
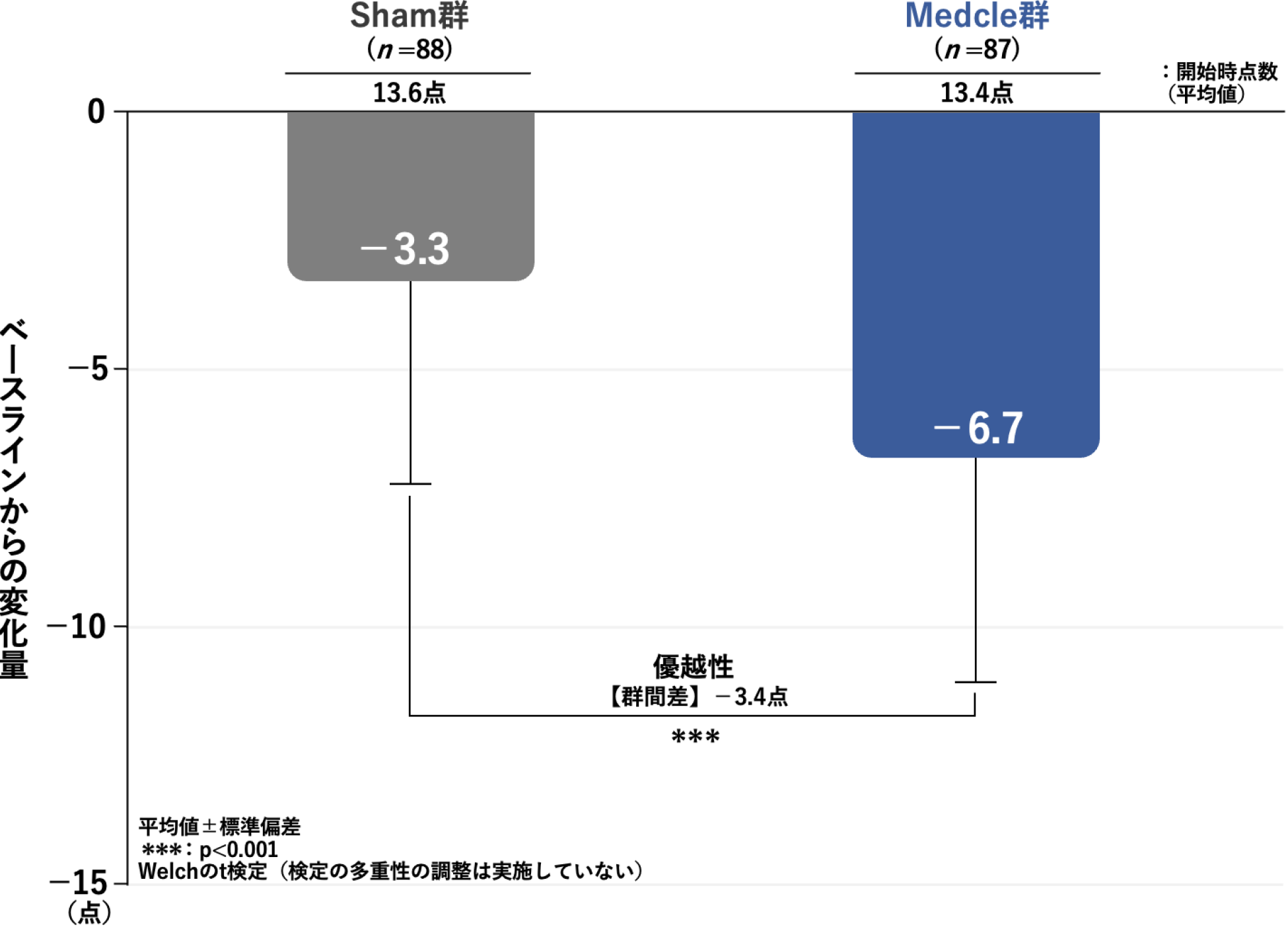
治療開始後8週時のAISのベースラインからの変化量[主要評価項目](検証的解析結果)
治療開始後8週時のAISのベースラインからの変化量(平均値)は、Sham群の-3.3点に対し、Medcle群では-6.7点と優位に低下しており、Medcle群のSham群に対する優越性が検証されました(p<0.001、Welchのt検定、検定の多重性の調整は実施していない)。
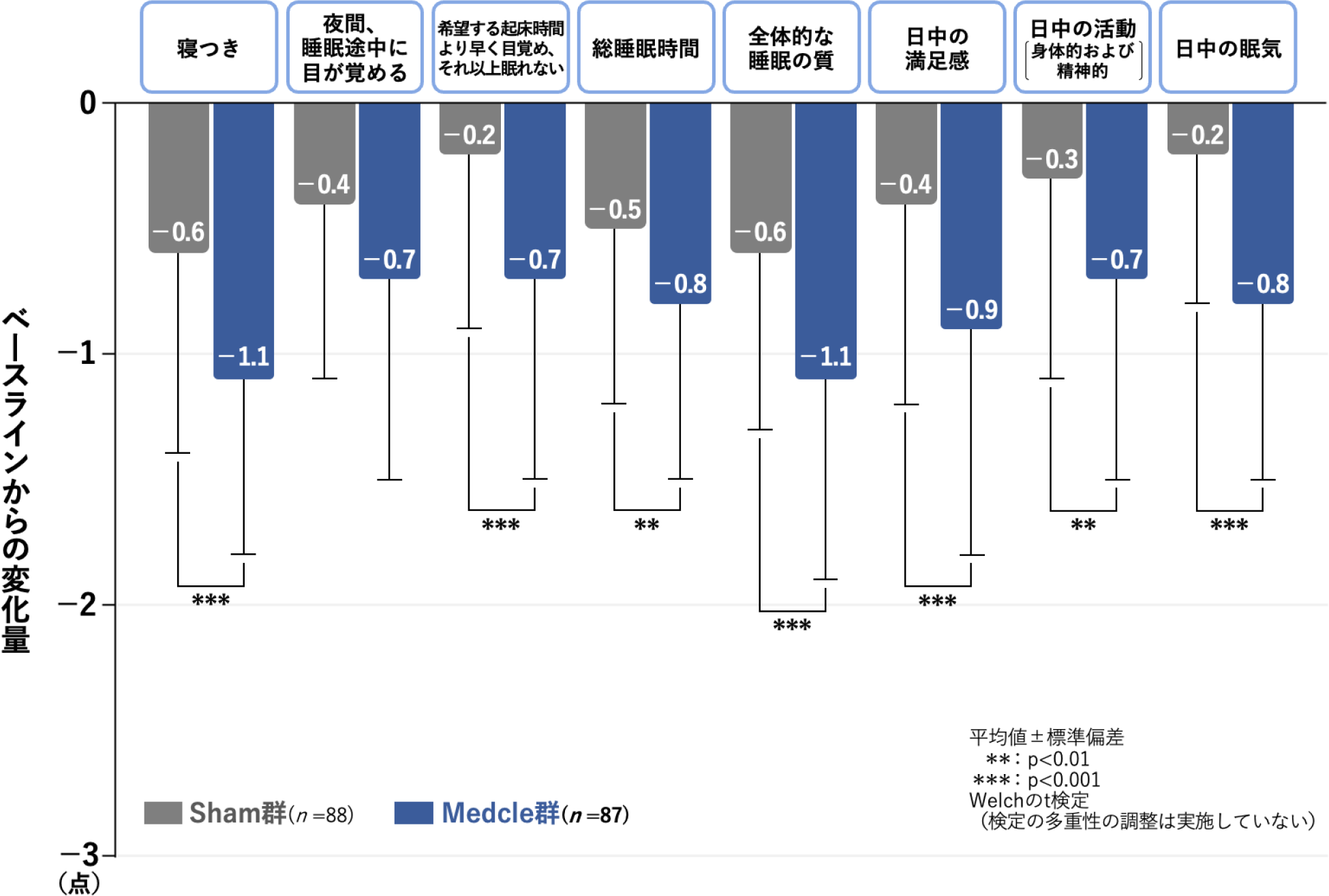
治療開始後8週時のAISの項目ごとのベースラインからの変化量[副次評価項目]
治療開始後8週時のAISの項目ごとのベースラインからの変化量(平均値)は、AISの全8項目中「夜間、睡眠途中に目が覚める」以外の7項目いずれも、Medcle群のSham群に対する優越性が認められました(7項目いずれもp<0.01、Welchのt検定(検定の多重性の調整は実施していない))。
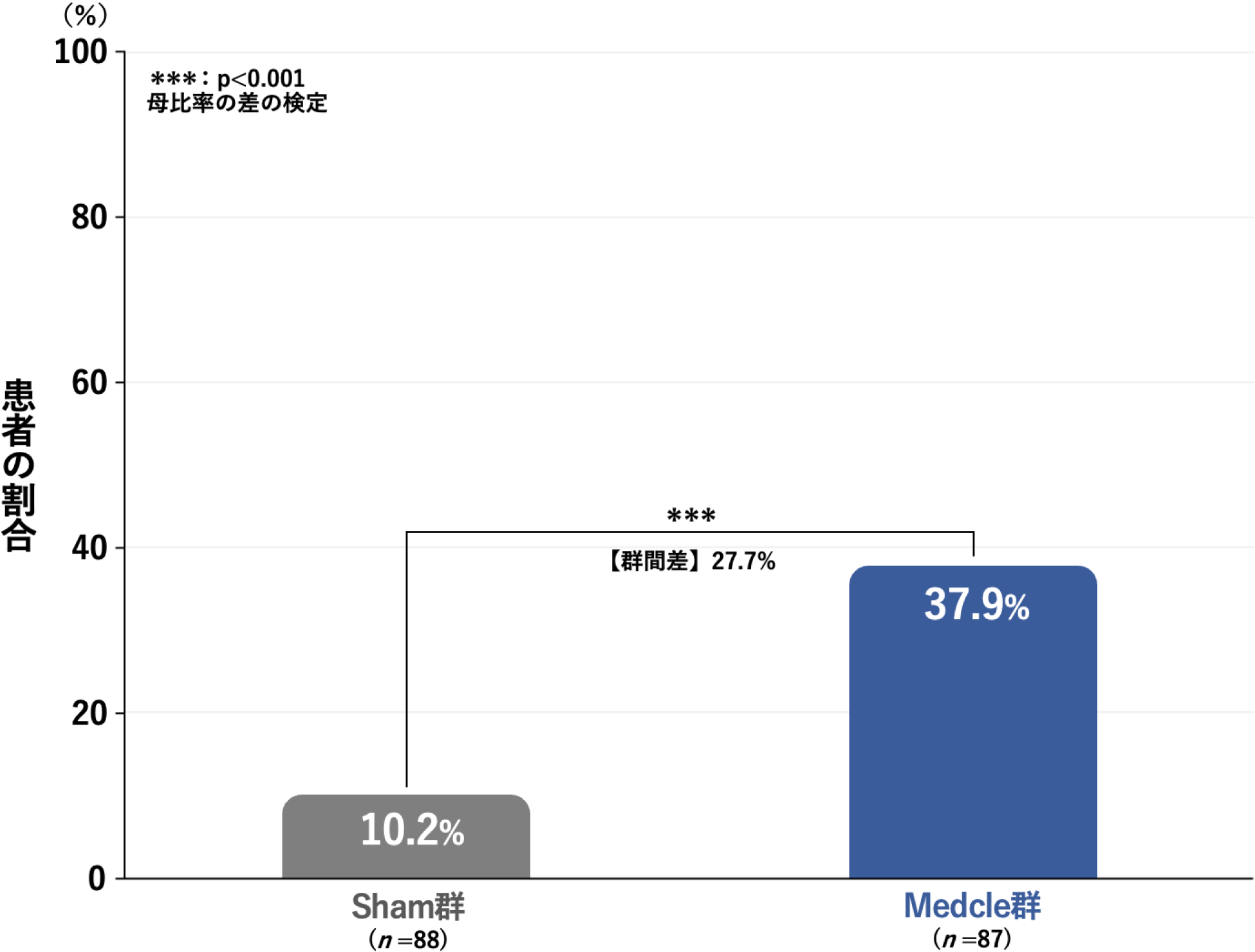
治療開始後8週時または中止時におけるAISが6点未満の患者の割合[副次評価項目]
治療開始後8週時または中止時(本試験では介入期間における中止例なし)において、不眠障害の疑いが「低い」とされるAIS6点未満の患者の割合は、Sham群の10.2%(9/88例)に対し、Medcle群では37.9%(33/87例)と有意に高くなりました(p<0.001、母比率の差の検定)。
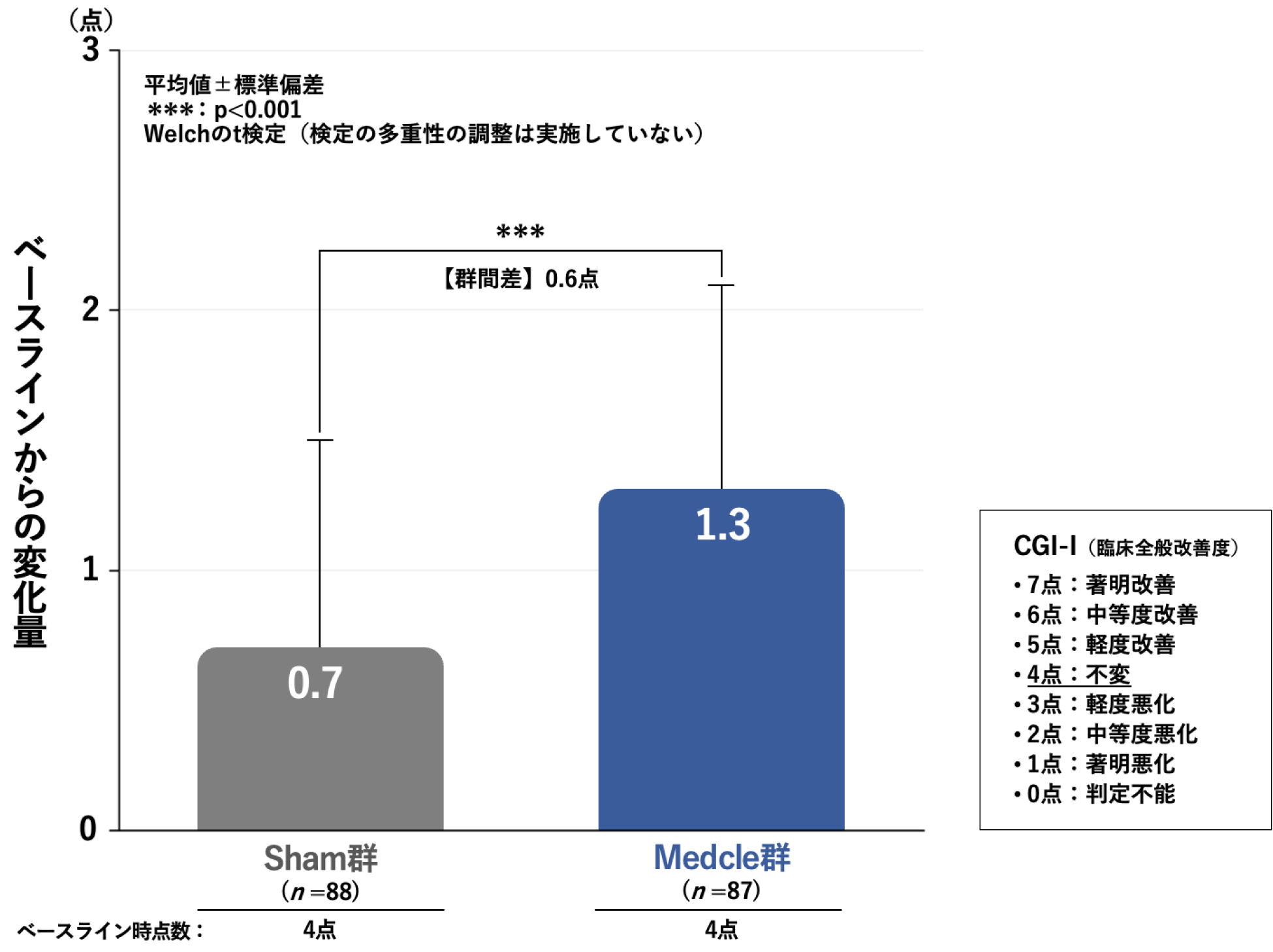
治療開始後8週時のCGI-Iのベースラインからの変化量[副次評価項目]
ベースライン時のCGI-Iを4点(不変)とした場合の、治療開始後8週時のCGI-Iのベースラインからの変化量(平均値)は、Sham群の0.7点に対し、Medcle群では1.3点と有意に増加しており、MedcleによりCGI-Iが改善しました(p<0.001、Welchのt検定、検定の多重性の調整は実施していない)。
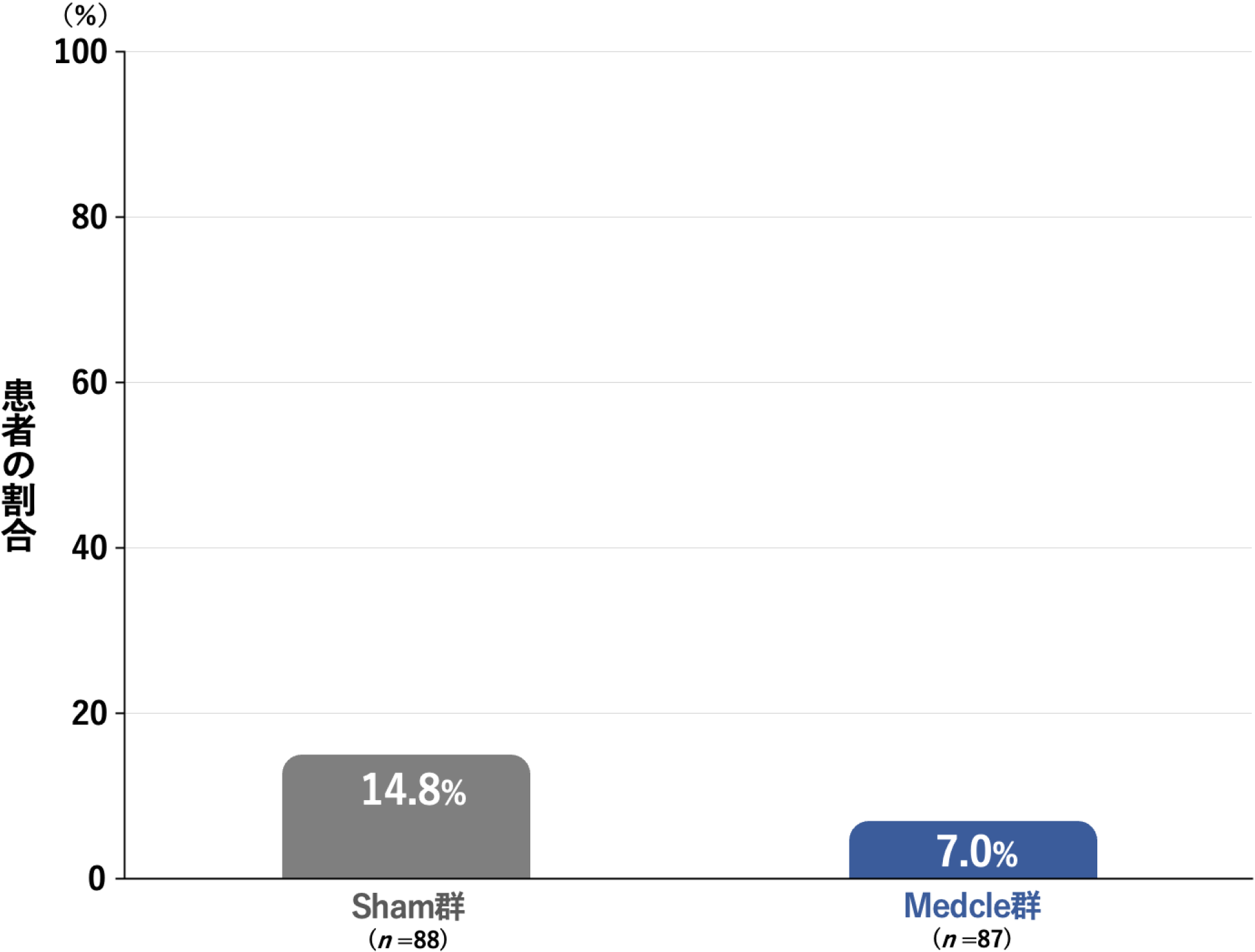
治験終了時または中止時に薬剤治療が必要と判断された患者の割合[副次評価項目]
治験終了時または中止時に薬剤治療が必要と判断された患者の割合は、Sham群の14.8%(13/88例)に対し、Medcle群では7.0%(6/87)でした。
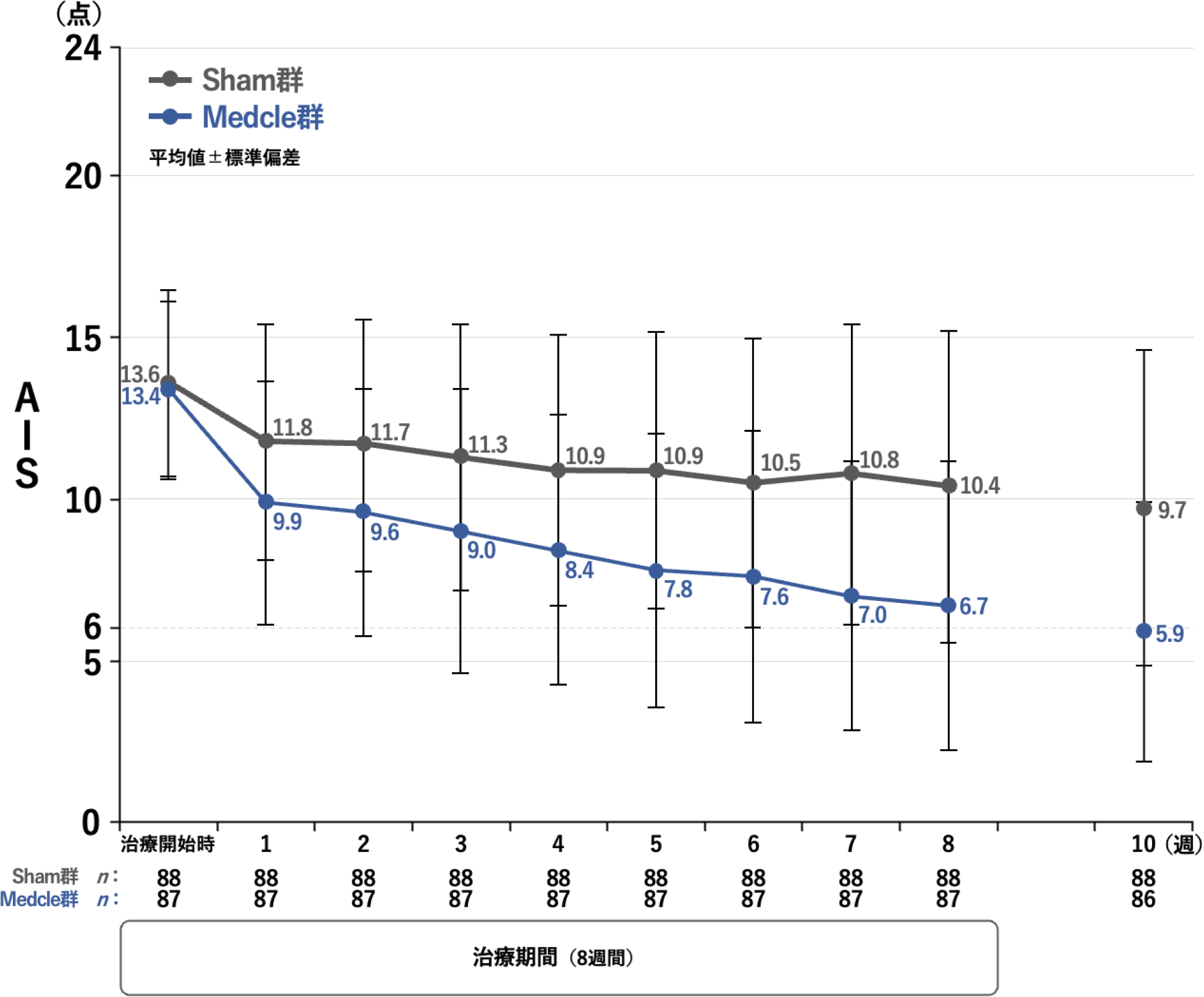
治療開始時からの治験終了時までのAISの推移[その他の解析]
治験開始時から治験終了時までのAIS(平均値)の推移は、以下のとおりでした。Sham群では、治療開始時は13.6点、治療開始後8週時には10.4点、10週時には9.7点であったのに対し、Medcle群では、治療開始時は13.4点、治療開始後8週時には6.7点、10週時には5.9点でした。
有害事象[安全性評価項目]
本試験において、有害事象の発現率は、Sham群では13.6% (12/88例) 、Medcle群では10.3%(9/87例)であり、主なもの(いずれかの群で発現率2%以上)は発熱〔Sham群8.0%(7/88例)、Medcle群3.4%(3/87例)〕、頭痛〔Sham群1.1%(1/88例)、Medcle群2.3% (2/87例) 〕でした。
なお、いずれの群においても「因果関係を否定できない」と判断された有害事象は認められませんでした。また、本試験において、中止に至った有害事象、重篤な有害事象、死亡は認められませんでした。
| Sham群 (n=88) | Medcle群 (n=87) | |
|---|---|---|
| 有害事象 | 12例 (13.6%) | 9例 (10.3%) |
| 軽度 | 12例 (13.6%) | 8例 (9.2%) |
| 中等度 | 0 | 1例 (1.1%) |
| 重度 | 0 | 0 |
| 因果関係を否定できない有害事象 | 0 | 0 |
| 中止に至った有害事象 | 0 | 0 |
| 重篤な有害事象(死亡を除く) | 0 | 0 |
| 死亡 | 0 | 0 |
不具合[安全性評価項目]
本試験において、不具合の発現率は、Sham群では1.1%(1/88例)、Medcle群では0%でした。不具合が認められたSham群の1例では、一時的な動作不良によりプッシュ通知を受信しない「その他」の不具合が発現しており、軽度ではありましたがアプリとの[因果関係が否定できない]と判断されました。なお、不具合について、繰り返しの発現は認められず消失しました。
| 因果関係を問わない | 因果関係を否定できない | |||
|---|---|---|---|---|
| Sham群 (n=88) | Medcle群 (n=87) | Sham群 (n=88) | Medcle群 (n=87) | |
| 不具合 | 1例 (1.1%) | 0 | 1例 (1.1%) | 0 |
| その他 | 1例 (1.1%) | 0 | 1例 (1.1%) | 0 |
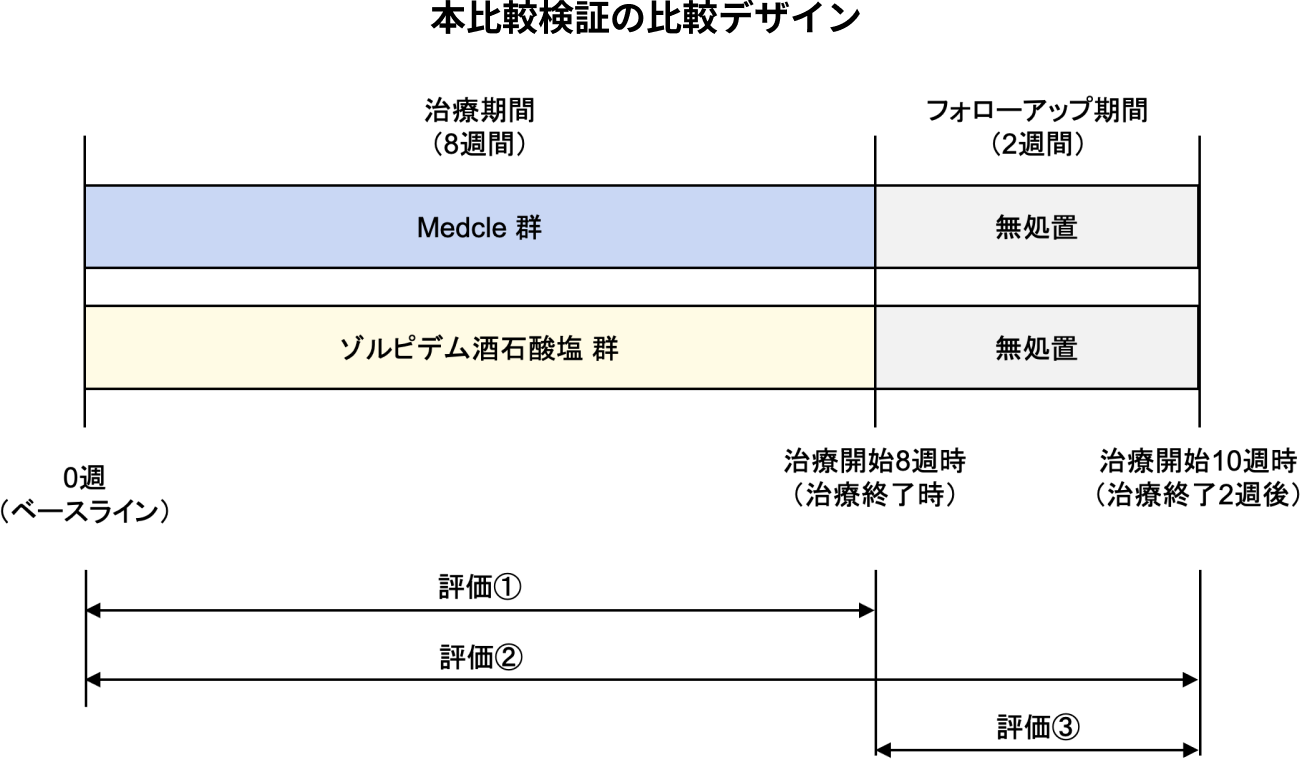
比較検証の目的
不眠障害患者を対象に、検証的試験SYK02試験で得られた治療開始後8 週時(治療終了時)、10 週時(治療終了後2 週時)の有効性を、臨床研究S02研究としてゾルピデム酒石酸塩5mg を1 日1 回就寝前に服用した場合の有効性と比較することで、本邦における不眠障害治療として広く用いられている薬物治療と同様の臨床的位置づけにおいて、Medcleが臨床的な有用性を発揮することを評価する。
対象
SYK02試験:外来の不眠障害患者175例のうち、Medcle群に割り付けられた87例(解析時)
S02研究:外来の不眠障害患者19例(解析時)
[主な選択・除外基準]
- SYK02試験とS02研究で同様
SYK02試験及びS02研究の結果を用いた比較検証の方法
SYK02治験及びS02研究にて入手したデータを使用し、有効性評価項目は両試験で同一であるため、得られたすべての評価項目に対して比較を行って、薬物療法(ゾルピデム酒石酸塩)に対する本品の臨床的有用性を検証した。
有効性評価項目
主要評価項目
- AISの変化量
副次評価項目
- AISの項目ごとの変化量
- AIS6点未満の患者の割合
- 医師による評価(CGI-Iの変化量、薬剤治療の要否)
- 入眠潜時,睡眠効率及び中途覚醒回数の変化量(睡眠表、アクチグラフ)
安全性評価項目
- 有害事象
評価期間
評価①:治療(Medcle使用・ゾルピデム酒石酸塩服用)終了時における治療効果
評価②:治療終了後のフォローアップ 2 週時点における治療効果
評価③:治療終了後の治療効果の持続性及び寛解率、反跳性不眠
解析計画
有効性の解析対象はmITTとした。主要評価項目および副次評価項目の「AISの変化量」、「AISの項目ごとの変化量」、「CGI-Iの変化量」「入眠潜時、睡眠効率及び中途覚醒回数の変化量(睡眠表、アクチグラフ)」の両群間の比較にはWelchのt検定(両群有意水準0.05)を用いた。「AIS6点未満の患者の割合」、「薬剤治療の要否」の両群間の比較には母比率の差の検定(両側有意水準0.05)を用いた。その他の解析である「AISの推移」については、各時点の要約統計量を算出した。
患者背景(mITT)
| ゾルピデム酒石酸塩群 (n=19) |
Medcle群 (n=87) |
|
|---|---|---|
| 年齢 平均値±標準偏差 | 44.1 ±12.8歳 | 42.4 ±13.5歳 |
| 20歳以上40歳未満 | 7例 | 41例 |
| 40歳以上65歳未満 | 12例 | 40例 |
| 65歳以上 | 0例 | 6例 |
| 性別 (男性 / 女性) | 7例 / 12例 | 32例 / 55例 |
| 既往歴・合併症 | ||
| あり | 2例 | 26例 |
| なし | 17例 | 61例 |
| 前治療薬 | ||
| あり | 0例 | 0例 |
| なし | 19例 | 87例 |
| 併用薬 | ||
| あり | 3例 | 26例 |
| なし | 16例 | 61例 |
| 併用療法 | ||
| あり | 0例 | 0例 |
| なし | 19例 | 87例 |
| 開始時のAIS 平均値±標準偏差 (点) | 13.4 ±2.8 | 13.4 ±2.8 |
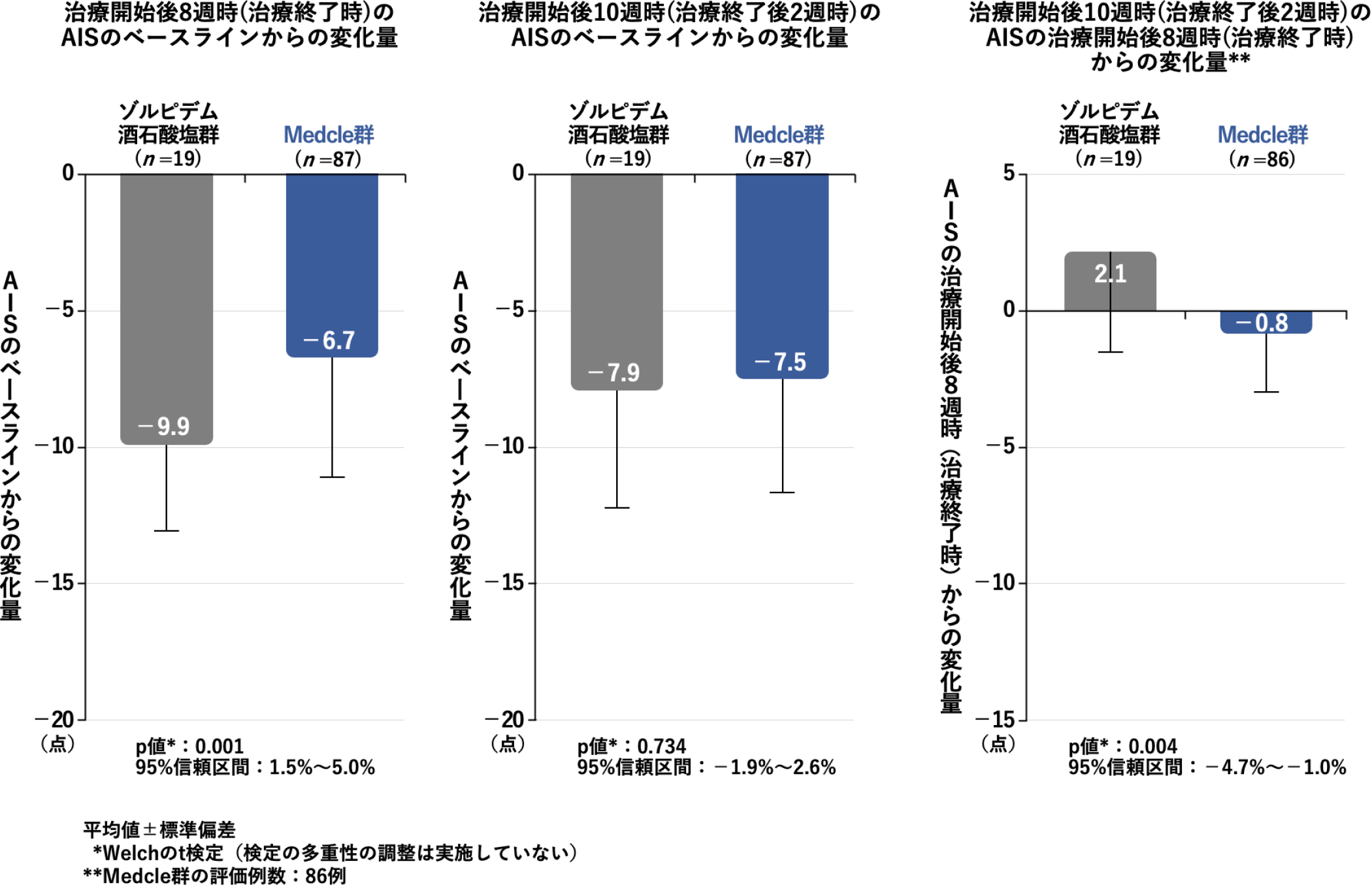
AISの変化量[主要評価項目]
治療開始後8週時(治療終了時)のAISのベースラインからの変化量は、Medcle群の-6.7点に対し、ゾルピデム酒石酸塩群では-9.9点であり、治療期間中の不眠症状の改善効果は、Medcle群に対してゾルピデム酒石酸塩群が有意に高いことが認められました。(p<0.001、Welchのt検定、検定の多重性の調整は実施していない)。
治療開始後10週時(治療終了2週後)のAISのベースラインからの変化量は、Medcle群の-7.5点に対し、ゾルピデム酒石酸塩群では-7.9点であり、Medcle群はゾルピデム酒石酸塩群と比較して不眠症状の改善効果に有意差は認められませんでした(p=0.734、Welchのt検定、検定の多重性の調整は実施していない)。
治療開始後8週時(治療終了時)から治療開始後10週時(治療終了2週後)のAISの変化量は、Medcle群の-0.8点に対し、ゾルピデム酒石酸塩群では2.1点であり、Medcle群はゾルピデム酒石酸塩群による治療と比較して、治療が終了した後の治療効果の持続性が有意に向上しました(p=0.004、Welchのt検定、検定の多重性の調整は実施していない)。
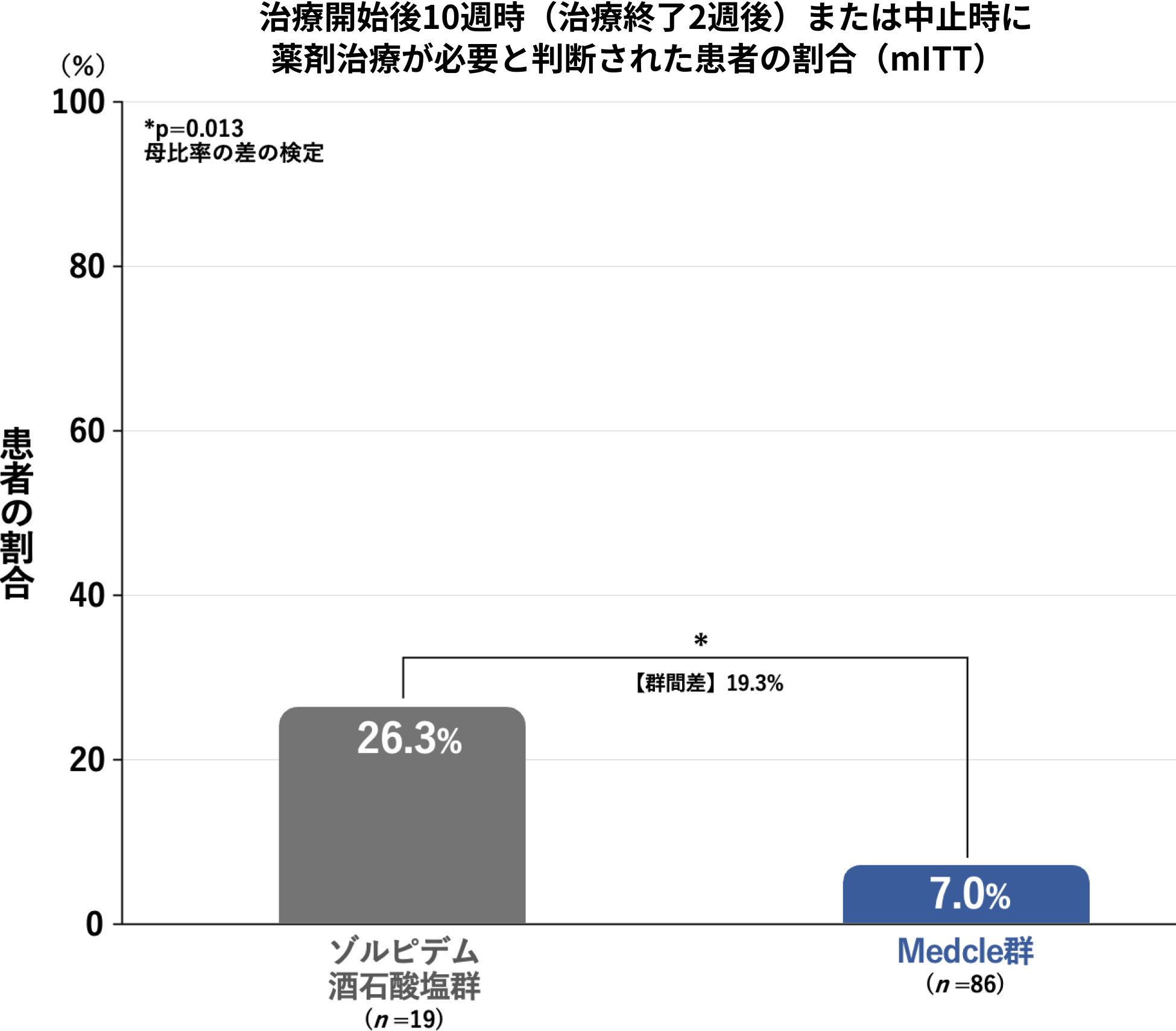
治療開始後10週時(治療終了2週後)または中止時の薬剤治療の要否[副次評価項目]
評価時点における治療効果の持続性などを踏まえ、医師により薬剤治療が必要と判断された患者の割合は、Medcle群で7.0%(6/86例)に対して、ゾルピデム酒石酸塩群で26.3%(5/19例)であり、Medcle群はゾルピデム酒石酸塩群による治療と比較して、治療終了後の治療効果の持続性と寛解率が医師の評価として有意に向上しました(p=0.013、母比率の差の検定)。
安全性
SYK02試験において、Medcle群の有害事象の発現率は10.3%であり、「因果関係を否定できない」と判断された有害事象は認められませんでした。
S02研究において、ゾルピデム酒石酸塩群の有害事象の発現率は10.5%であり、使用薬剤との「因果関係が否定できない」と判断された有害事象は認められませんでした。また、中止に至った有害事象、死亡、重篤な有害事象及び重度の有害事象の発現はなく、発現した有害事象はいずれも軽度でした。
副次評価項目の一部は示されておりません。詳細はサスメド株式会社にお問い合わせください。
用語
- AIS:アテネ不眠尺度
- ICSD-3:睡眠障害国際分類第3版
- M.I.N.I:精神疾患簡易構造化面接法
- CGI-I:臨床全般改善度
- mITT:modified intention to treat
